ATP-syntase -mer enn spinning
Av David Coppedge; 23.3.2024. Overatt herfra
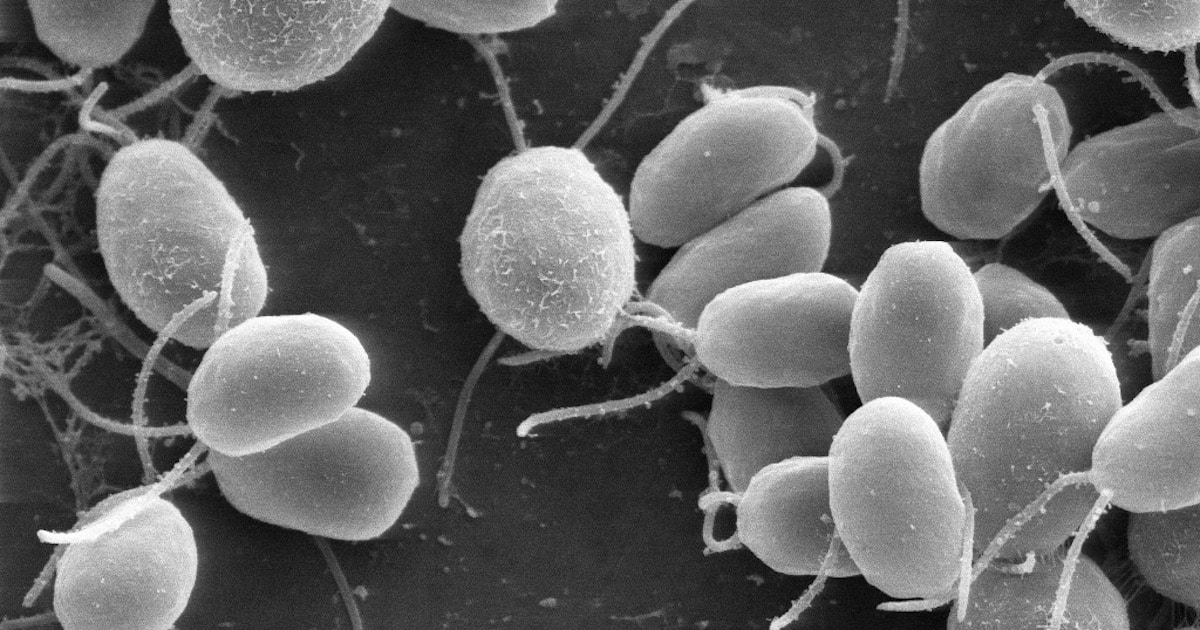 Bilde 1. Chlamydomonas
Bilde 1. Chlamydomonas
Det biokjemiske ikonet til roterende maskiner, ATP-syntase, forblir i nyhetene, med nye funn. Nå som kryo-elektronmikroskopi er mye brukt, ser biofysikere på funksjonen til individuelle underenheter av motorene og finner ut hva de gjør. Det faktum at molekylære maskiner viser mer funksjonell eleganse jo nærmere man ser etter, indikerer at intelligent design er den beste forklaringen.
Automatisk brems
Dyr og planter inneholder begge disse vitale rotasjonsmotorene som dekker energibehovet deres i ATP. Hos dyr finnes de i mitokondrier. I planter og andre fotosyntetiske organismer finnes de i kloroplaster. Fotosyntese, som er avhengig av lys, har et problem: Når det er mørkt, kan rotasjonsmotorene deres begynne å gå i revers, og risikerer "en sløsende ATP-hydrolysereaksjon".
Ved å jobbe med grønnalgen Chlamydomonas reinhardtii (bildet til høyre ) som en "modellorganisme", tok et team på åtte japanske forskere en nærmere titt på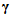 -underenheten i kloroplast ATP-syntase (dette er "kamakselen"-delen av motoren som driver syntese av ATP i F1-domenet). De fant at to spesifikke domener i
-underenheten i kloroplast ATP-syntase (dette er "kamakselen"-delen av motoren som driver syntese av ATP i F1-domenet). De fant at to spesifikke domener i 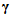 -underenheten fungerer som en automatisk brems i mørket. De skrev i PNAS -lenke, i januar,
-underenheten fungerer som en automatisk brems i mørket. De skrev i PNAS -lenke, i januar,
 -Blant FoF1-ATP-syntasekompleksene til alle organismer, er kloroplast FoF1 (CFoCF1) et unikt enzym med en redoksreguleringsmekanisme; den underliggende mekanismen for redoksregulering av adenosintrifosfat (ATP) syntesereaksjonen i CFoCF1 har imidlertid ikke blitt fullstendig belyst. Ved å utnytte den kraftige genetikken til Chlamydomonas reinhardtii som en modellorganisme for fotosyntese, gjennomførte vi en omfattende biokjemisk analyse av CFoCF1-molekylet. Her identifiserer vi strukturelle determinanter for kinetikken til den intracellulære redoksresponsen og demonstrerer at redoksreguleringen av ATP-syntese oppnås ved den samarbeidende interaksjonen mellom to y-underenhetsdomener av CFoCF1 som er unike for fotosyntetiske organismer.
-Blant FoF1-ATP-syntasekompleksene til alle organismer, er kloroplast FoF1 (CFoCF1) et unikt enzym med en redoksreguleringsmekanisme; den underliggende mekanismen for redoksregulering av adenosintrifosfat (ATP) syntesereaksjonen i CFoCF1 har imidlertid ikke blitt fullstendig belyst. Ved å utnytte den kraftige genetikken til Chlamydomonas reinhardtii som en modellorganisme for fotosyntese, gjennomførte vi en omfattende biokjemisk analyse av CFoCF1-molekylet. Her identifiserer vi strukturelle determinanter for kinetikken til den intracellulære redoksresponsen og demonstrerer at redoksreguleringen av ATP-syntese oppnås ved den samarbeidende interaksjonen mellom to y-underenhetsdomener av CFoCF1 som er unike for fotosyntetiske organismer.
Figur 6 i artikkelen (gjengitt av Phys.org) viser hvordan de to domenene fungerer som en stopper:
Den stramme konformasjonen svekker interaksjonen mellom redoksløkken og 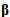 -hårnålen. Følgelig forblir β-'hårnålen' fast i hulrommet mellom α- og β-underenheten, som en stopper, og hemmer rotasjonen av den sentrale stilken (
-hårnålen. Følgelig forblir β-'hårnålen' fast i hulrommet mellom α- og β-underenheten, som en stopper, og hemmer rotasjonen av den sentrale stilken (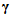 εc-ringen). I redusert form gjenvinner redoksløkken fleksibiliteten til å samhandle med β-hårnålen. Redoksløkken samhandler for å trekke ut β-hårnålen fra hulrommet, og akselererer dermed den sentrale stengelen, som en samarbeidende regulator.
εc-ringen). I redusert form gjenvinner redoksløkken fleksibiliteten til å samhandle med β-hårnålen. Redoksløkken samhandler for å trekke ut β-hårnålen fra hulrommet, og akselererer dermed den sentrale stengelen, som en samarbeidende regulator.
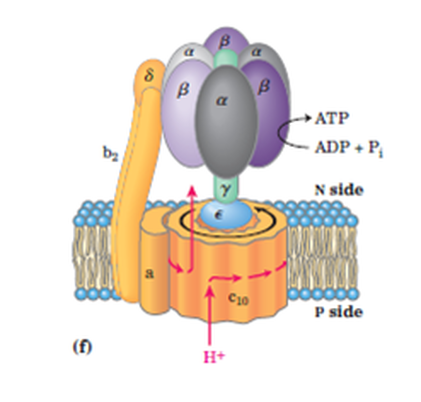
Bilde 2. ATP-motor
Se på Snap
Et annet japansk team -lenke, dette fra Tokio Universitet, så nærmere på den 'katalytiske tilstanden' i F1-domenet til ATP-syntasemotoren der ADP konverteres til ATP med tilsetning av et fosfat. F1-domenet har 3 par α, β-underenheter arrangert som kronbladene til en blomst, hvert par i en annen aktivitetsfase: innsetting av ingredienser, katalyse og utstøting av ATP. 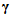 -underenheten, som en kamaksel, aktiverer hvert α,
-underenheten, som en kamaksel, aktiverer hvert α, 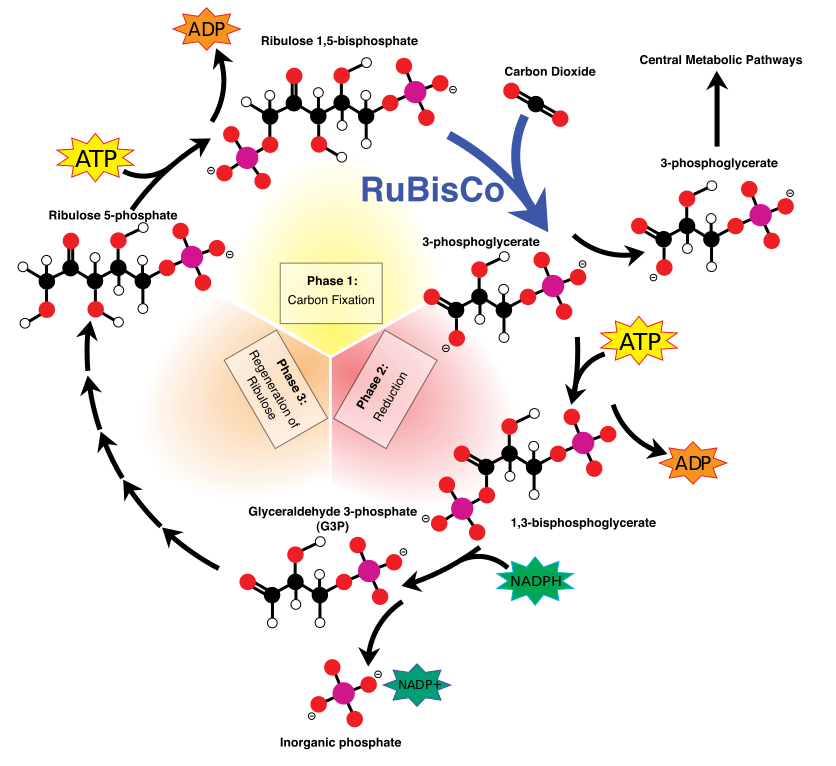 β-par etter tur når den roterer hele 360
β-par etter tur når den roterer hele 360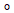 . Ved å dele på tre, føler hvert α, β-par kraften til kamakselen under katalysestadiet (ADP + P gir ATP) innenfor 120
. Ved å dele på tre, føler hvert α, β-par kraften til kamakselen under katalysestadiet (ADP + P gir ATP) innenfor 120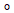 ved hver full omdreining av veivakselen. På de andre tidspunktene mottar paret enten ingrediensene eller kaster ut den ferdige ATP. Når den kjøres i revers, blir F1-motoren en ATP-deler, som hydrolyserer ATP for å gi ADP og P, og skyter ut protoner i prosessen. Ved hydrolyse blir ATP drivstoffet for å få motoren til å gå i revers.
ved hver full omdreining av veivakselen. På de andre tidspunktene mottar paret enten ingrediensene eller kaster ut den ferdige ATP. Når den kjøres i revers, blir F1-motoren en ATP-deler, som hydrolyserer ATP for å gi ADP og P, og skyter ut protoner i prosessen. Ved hydrolyse blir ATP drivstoffet for å få motoren til å gå i revers.
Bilde 3. Innfløkte prosesser involvert
Under normal drift katalyserer motoren ATP. Biofysikere har lenge mistenkt at kamakselen (y-underenheten) utøver press på den innkommende ADP og P for å feste dem sammen. Hvis 0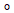 representerer øyeblikket ATP er katalysert, har tidligere studier funnet et kort pausestadium ved 80
representerer øyeblikket ATP er katalysert, har tidligere studier funnet et kort pausestadium ved 80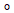 og en lengre opphold ved de påfølgende 40
og en lengre opphold ved de påfølgende 40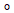 rotasjon, som representerer det "kjemomekaniske koblingsskjemaet", som papiret deres kaller det.
rotasjon, som representerer det "kjemomekaniske koblingsskjemaet", som papiret deres kaller det.
I den omvendte reaksjonen var imidlertid vinkelen for spaltning av ATP uavklart. Teamet laget en hybrid ATP-syntase som løp ekstremt sakte slik at de kunne observere "verdens minste roterende biologiske molekylmotor" som gikk i revers. Hybriden deres tillot dem å måle vinkelen der ATP-spalting inntreffer.
-Som et resultat viste den nye hybrid F1 to pausevinkler som er atskilt med 200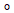 . De kan tilskrives to senkede reaksjonstrinn i den muterte
. De kan tilskrives to senkede reaksjonstrinn i den muterte 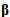 , og gir dermed direkte bevis for at ATP-spalting skjer ved 200
, og gir dermed direkte bevis for at ATP-spalting skjer ved 200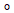 i stedet for 80
i stedet for 80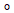 etter ATP-binding ved 0
etter ATP-binding ved 0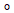 . Dette scenariet løser det langvarige uavklarte problemet i det kjemomekaniske koblingsskjemaet og gir innsikt i mekanismen for å drive ensrettet rotasjon.
. Dette scenariet løser det langvarige uavklarte problemet i det kjemomekaniske koblingsskjemaet og gir innsikt i mekanismen for å drive ensrettet rotasjon.
Se "Graphical Abstract" i artikkelen som illustrerer denne "ekstremt lange pausen" de målte. Funnet avslører at i begge retninger, er ATP-syntase finjustert for sitt arbeid. Omvendt retning (hydrolyse) er ikke bare som en motor som lekker drivstoff. Dens deler virker med presisjon for å spalte ATP på en bestemt måte.
Innsikt i en relatert rotasjonsmotor
Det er en fetter til ATP-syntase. Det er en protonpumpe kalt V-ATPase (vakuolær type adenosintrifosfatase), og dens katalytiske deler er merket V1Vo i stedet for F1Fo. Som sin motpart, kjører V-ATPase med en roterende handling, men bruker ATP for å pumpe protoner inn i organeller. Dens jobb er å surgjøre vakuoler og andre organeller eller intracellulære rom, som trenger en lavere pH for å fungere. Vo-delen pumper protonene (H+ ioner) inn i vakuolen, og øker surheten. En liten tanke viser at en slik motor kan være farlig. Vil du ha en syregenererende motor som løper løpsk?
Forskere fra et sykehus i Toronto, publiserte i PNAS -lenke, var nysgjerrige på å finne ut hvordan disse syrepumpene bygges, uten å skade cellen. Vo-komplekset settes sammen i endoplasmatisk retikulum (ER) og transporteres deretter til Golgi-apparatet for å kombineres med V1. Hvilken kvalitetskontrollmekanisme holder domenene inaktivert til de er ferdig montert, og klare for handling?
 Ved hjelp av kryo-elektronmikroskopi avbildet teamet tre proteiner (Vma12p, Vma22p og Vma21p) som må fungere sammen for å oppnå kvalitetskontrollen for sikker håndtering av syrepumpene under montering. "De resulterende strukturene," fant de, "viser hvordan en sekvens av koordinerte interaksjoner og konformasjonsendringer sikrer at bare riktig montert Vo forlater ER, og protonpumping inn i den nøytrale ER unngås." Å søle syre inn i akuttmottaket kan være ille! "Ikke overraskende," bemerker de, "på grunn av deres betydning for Vo-montering, har mutasjoner i humane homologer av Vma12p, Vma22p og Vma21p blitt knyttet til sykdom." Så hvordan utfører disse tre essensielle proteinene kvalitetskontroll? Vil du virkelig vite det?
Ved hjelp av kryo-elektronmikroskopi avbildet teamet tre proteiner (Vma12p, Vma22p og Vma21p) som må fungere sammen for å oppnå kvalitetskontrollen for sikker håndtering av syrepumpene under montering. "De resulterende strukturene," fant de, "viser hvordan en sekvens av koordinerte interaksjoner og konformasjonsendringer sikrer at bare riktig montert Vo forlater ER, og protonpumping inn i den nøytrale ER unngås." Å søle syre inn i akuttmottaket kan være ille! "Ikke overraskende," bemerker de, "på grunn av deres betydning for Vo-montering, har mutasjoner i humane homologer av Vma12p, Vma22p og Vma21p blitt knyttet til sykdom." Så hvordan utfører disse tre essensielle proteinene kvalitetskontroll? Vil du virkelig vite det?
-Strukturene beskrevet ovenfor antyder sekvensen av hendelser som oppstår under Vo-montering i ER-membranen og påfølgende binding av V1 i Golgi .... C-ringen samles rundt Voa1p, med binding av underenhet d til c8c'c" Voa1p-ringen som maskerer ER-hentingsmotivet til Voa1p.
VoΛaef:Vma12-22p-strukturen indikerer at Vma12-22p-komplekset binder denne fullstendig sammensatte ringen før interaksjon med underenhetene a, e og f (fig. 4A). Vma12-22p hjelper med å rekruttere og sikre interaksjonen mellom underenhet a og c-ringen gjennom interaksjon av Vma12p med underenhetene a og d...
Bilde 4. Gruppering av vitenskaper
Deres siste setning
OK, OK. Det er nok å si at et komplisert sett med interaksjoner finner sted for å sikre at V-ATPase-montering er trygg! Biokjemikere kan ønske å arbeide gjennom detaljene. Heldigvis ga forfatterne diagrammer og animasjoner for å illustrere dynamikken i alle disse arbeidsdelene. Legg merke til den siste setningen deres: "Det er viktig at strukturene illustrerer hvordan Vma21p og Vma12-22p spiller sentrale roller i både V-ATPase-montering og kvalitetskontroll."
Kvalitetskontroll: det er et ingeniørkonsept som gjennomsyrer alle disse tre studiene. Uten kvalitetskontroll ville disse nanoskopiske rotasjonsmotorene, som alt liv er avhengig av, aldri vare - og faktisk, aldri dukke opp i utgangspunktet. Kvalitetskontroll hører hjemme i arbeidsvokabularet for intelligent design og ingeniørkunst. Det finnes ikke i Darwins ordbok.
 David Coppedge
David Coppedge
David Coppedge er en frilans vitenskapsreporter i Sør-California. Han har vært styremedlem i Illustra Media siden grunnleggelsen og fungerer som deres vitenskapskonsulent. Han jobbet ved NASAs Jet Propulsion Laboratory (JPL) i 14 år, på Cassini-oppdraget til Saturn, til han ble kastet ut i 2011 for å ha delt materiale om intelligent design, en diskriminerende handling som førte til en nasjonalt publisert rettssak i 2012. Discovery Institute støttet saken hans, men en ensom dommer dømte mot ham uten forklaring. En naturfotograf, friluftsmann og musiker, David har B.S. grader i realfagsutdanning og i fysikk og holder presentasjoner om ID og andre vitenskapelige emner.
Bilde 5. David Coppedge
Oversatt via Google oversetter, sett gjennom av Asbjørn E. Lund
 Bilde 1. Chlamydomonas
Bilde 1. Chlamydomonas  Bilde 1. Chlamydomonas
Bilde 1. Chlamydomonas  -Blant FoF1-ATP-syntasekompleksene til alle organismer, er kloroplast FoF1 (CFoCF1) et unikt enzym med en redoksreguleringsmekanisme; den underliggende mekanismen for redoksregulering av adenosintrifosfat (ATP) syntesereaksjonen i CFoCF1 har imidlertid ikke blitt fullstendig belyst. Ved å utnytte den kraftige genetikken til Chlamydomonas reinhardtii som en modellorganisme for fotosyntese, gjennomførte vi en omfattende biokjemisk analyse av CFoCF1-molekylet. Her identifiserer vi strukturelle determinanter for kinetikken til den intracellulære redoksresponsen og demonstrerer at redoksreguleringen av ATP-syntese oppnås ved den samarbeidende interaksjonen mellom to y-underenhetsdomener av CFoCF1 som er unike for fotosyntetiske organismer.
-Blant FoF1-ATP-syntasekompleksene til alle organismer, er kloroplast FoF1 (CFoCF1) et unikt enzym med en redoksreguleringsmekanisme; den underliggende mekanismen for redoksregulering av adenosintrifosfat (ATP) syntesereaksjonen i CFoCF1 har imidlertid ikke blitt fullstendig belyst. Ved å utnytte den kraftige genetikken til Chlamydomonas reinhardtii som en modellorganisme for fotosyntese, gjennomførte vi en omfattende biokjemisk analyse av CFoCF1-molekylet. Her identifiserer vi strukturelle determinanter for kinetikken til den intracellulære redoksresponsen og demonstrerer at redoksreguleringen av ATP-syntese oppnås ved den samarbeidende interaksjonen mellom to y-underenhetsdomener av CFoCF1 som er unike for fotosyntetiske organismer.  β-par etter tur når den roterer hele 360
β-par etter tur når den roterer hele 360 Ved hjelp av kryo-elektronmikroskopi avbildet teamet tre proteiner (Vma12p, Vma22p og Vma21p) som må fungere sammen for å oppnå kvalitetskontrollen for sikker håndtering av syrepumpene under montering. "De resulterende strukturene," fant de, "viser hvordan en sekvens av koordinerte interaksjoner og konformasjonsendringer sikrer at bare riktig montert Vo forlater ER, og protonpumping inn i den nøytrale ER unngås." Å søle syre inn i akuttmottaket kan være ille! "Ikke overraskende," bemerker de, "på grunn av deres betydning for Vo-montering, har mutasjoner i humane homologer av Vma12p, Vma22p og Vma21p blitt knyttet til sykdom." Så hvordan utfører disse tre essensielle proteinene kvalitetskontroll? Vil du virkelig vite det?
Ved hjelp av kryo-elektronmikroskopi avbildet teamet tre proteiner (Vma12p, Vma22p og Vma21p) som må fungere sammen for å oppnå kvalitetskontrollen for sikker håndtering av syrepumpene under montering. "De resulterende strukturene," fant de, "viser hvordan en sekvens av koordinerte interaksjoner og konformasjonsendringer sikrer at bare riktig montert Vo forlater ER, og protonpumping inn i den nøytrale ER unngås." Å søle syre inn i akuttmottaket kan være ille! "Ikke overraskende," bemerker de, "på grunn av deres betydning for Vo-montering, har mutasjoner i humane homologer av Vma12p, Vma22p og Vma21p blitt knyttet til sykdom." Så hvordan utfører disse tre essensielle proteinene kvalitetskontroll? Vil du virkelig vite det? David Coppedge
David Coppedge